Isomer adalah senyawa-senyawa yang mempunyai rumus molekul sama. Nah, kenapa sih bisa terjadi isomer? Hal ini dikarenakan adanya perbedaan struktur dan konfigurasinya.
Keisomeran terbagi atas 2 macam lho, yaitu:
- Keisomeran struktur: Keisomeran yang disebabkan oleh perbedaan struktur (isomer kerangka, posisi, dan gugus fungsi)
- Keisomeran ruang: Keisomeran yang disebabkan adanya perbedaan konfigurasi (isomer geometris dan isomer optis)
Gugus alkil adalah gugus senyawa hidrokarbon yang memiliki rumus CnH2n+1, dengan atom H-nya selalu kebagian nomor ganjil. Gugus alkil di sini juga digunakan sebagai penentuan keisomeran turunan alkana. Tabel di bawah adalah tabel jumlah gugus alkil:

- Keisomeran kerangka

- Keisomeran posisi

- Keisomeran gugus fungsi
Nah, keisomeran gugus fungsi terjadi pada [Alkohol dan eter], [Aldehida dan keton], [Asam karboksilat dan ester]. Lho kok gitu? Ya, karena memiliki “rumus molekul yang sama” toh!

- Keisomeran geometris
- Cis: gugus sejenis terletak pada sisi yang sama (sejajar)
- Trans: gugus sejenis terletak bersebrangan (bersilangan)
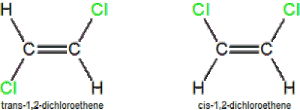
- Keisomeran optis

Nah, isomer optis bisa juga berputar tidak seperti halnya isomer geometris. Arah putarnya pun bisa berlawan arah jarum jam, atau searah jarum jam.
- Searah arah jarum jam (kanan) = levo = l
- Berlawanan arah jarum jam (kiri) = dekstro = d

Atom karbon asimetris ditandai dengan sifat kiral. Senyawa ini diibaratkan tangan kanan yang tidak setangkup dengan tangan kiri tetapi masih memiliki komposisi yang sama. Jadi, jika tangan kanan ditangkupkan dengan tangan kiri, maka yang akan setangkup hanya jari tengah, selebinya setangkup berlawanan jenis. Nah, seperti itulah senyawa kiral dan atom karbon asimetris.
Nah, ada peraturan mengenai atom karbon asimetris, yaitu:
- Semakin banyak jumlah atom karbon asimetris, semakin banyak konfigurasi molekulnya dan semakin banyak pula isomer optisnya
- Rumus menyatakan banyaknya isomer optis adalah 2^n (dua pangkat n) ; dengan n adalah banyaknya atom karbon asimetris
CONTOH SOAL
- Senyawa berikut yag memperlihatkan keisomeran optis adalah …
A. sek-butil alkohol
B. butil alkohol
C. isobutil alkohol
D. isopropil alkohol
E. ters-butil alkohol
–> Penyelesaian:

PEMBAHASAN SOAL NOMOR 1 - Di antara senyawa-senyawa berikut yang mempunyai isomer optis adalah …
A. CH3CH2COOH
B. CH2OHCH2COOH
C. (CH3)3CCOOH
D. CH3CHOHCOOH
E. CH3CH2CH2COOH
–> Penyelesaian:
PEMBAHASAN SOAL NOMOR 2